در صنایع گوناگونی از آمونیوم کلرید به عنوان مواد اولیه استفاده میشود. اگر بخواهیم به پیشینه استفاده از این ماده اشاره کنیم باید به کاربرد آمونیوم کلرید در مواد آتش زا و همچنین استفاده از آن در آتش بازیها به جهت افزایش رنگ سبز و آبی یونهای مس اشاره کنیم.
امروزه دو صنعت کشاورزی و کودهای شیمیایی حاوی نیتروژن صنایعی هستند که از آمونیوم کلراید بهره میبرند. علاوه بر این، از واکنشهای آمونیوم کلراید(نشادر) نیز استفادههای گوناگونی میشود، در ادامه همین مقاله به معرفی واکنشهای نشادر با مواد دیگر نیز خواهیم پرداخت.
اما چرا با وجود آمونیوم سولفات از نشادر استفاده میشود؟ آمونیوم کلراید در مقایسه با آمونیوم سولفات از هزینه کمتر و غلظت بالاتری برخوردار است. تا به امروز از این ماده مقرون به صرفه برای محصولاتی مانند گندم، جو، نیشکر و… استفاده میشود.
کاربرد آمونیوم کلرید در کشاورزی بدین صورت است که کلر به خاک اضافه میشود تا کادمیم بیشتری توسط گیاهان جذب شود. در ادامه علاوه بر اینکه به به مزایای نشادر اشاره میکنیم، به مهم ترین واکنشهایی که نشادر میتواند در آن نقش داشته باشد اشاره خواهیم کرد.
بیشتر بخوانید: خواص گلیسیرین برای پوست
کاربرد و استفاده در صنعت نساجی و چرم
- در صنایعی همچون چاپ پارچه، رنگرزی و خوشه بندی پنبه مورد استفاده قرار میگیرد.
- برای ساخت مدارهای چاپی و حکاکی بر روی آنها در صنعت الکترونیک کاربرد دارد.
- به عنوان یک ماده افزودنی همچون مخمرها در نانوایی در صنایع غذایی استفاده میشود.
- نقش پر رنگی را در تولید محصولات شوینده و تمیز کننده بازی میکند.
- به منظور پیشگیری از سنگ ادراری دامها در دامپزشکی نیز موثر میباشد.
- در فرایند تولید چسب اتصال دهنده تختههای سه لایه از آن استفاده میشود.
- در حمامهای خنک کننده در طول تاریخ به عنوان عاملی برای ایجاد دمای پایین به شمار میآیند.
- در برخی از نوشیدنیها نقش اسانس و طعم دهنده خواهد داشت.
- برای گاوها و دامها به عنوان یک مکمل خوراکی کاربرد دارد.
واکنش نشادر با آب
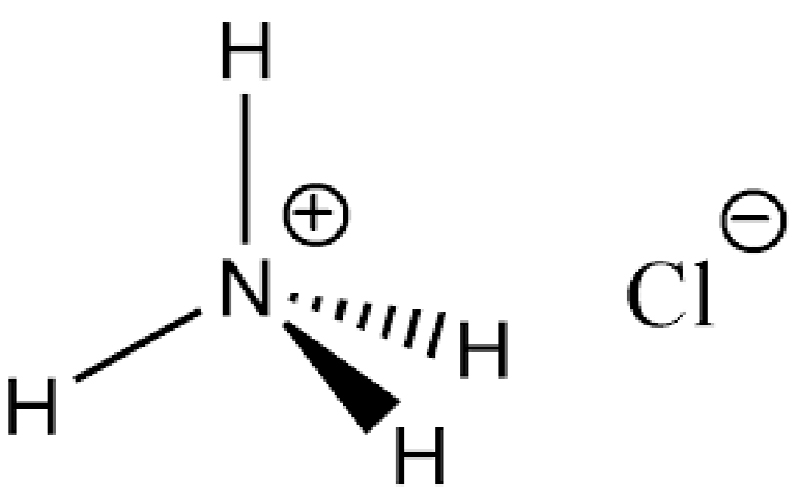
نشادر نامی است که فرمول شیمیایی NH4Cl به خود اختصاص میدهد، البته این ماده با نام علمی آمونیوم کلرید نیز شناخته میشود که واکنشهای آمونیوم کلراید (نشادر) میتواند مواد گوناگونی را ایجاد کند.
اگر بخواهیم به ظاهر آن اشارهای داشته باشیم باید بگوییم که این ماده به صورت یک نمک بلوری سفید رنگ دیده میشود که قابلیت انحلال پذیری بالایی را در آب از خود نشان میدهد.
از واکنش نشادر با آب مقداری حرارت ایجاد میشود که اگر ظرف حاوی محلول را در دستتان بگیرید گرمای آن را احساس خواهید کرد. این واکنش گرماگیر بوده و در صورت حل شدن در آب سرمای جزئی را به همراه دارد، در ادامه ترکیب شیمیایی این ماده با آب قابل مشاهده میباشد.
(NH4Cl (s)+ H2O (l)—> NH4Cl (aq) + H2O (l
واکنش کلرید آمونیوم (نشادر) با کربنات
نشادر نیز با کربناتهای فلز قلیایی در دماهای بالا واکنش نشان میدهد و آمونیاک و کلرید فلز قلیایی را تولید میکند. در صورتی که کلرید آمونیوم با کربنات فلزات قلیایی وارد واکنش شود، نتیجهی این واکنش در عین اینکه با خارج شدن حرارت بالا همراه است، تولید آمونیاک و کلرید فلز قلیایی را نیز در پی خواهد داشت.
2NH4Cl + Na2CO3 → 2 NaCl + CO2 + H2O + 2 NH3
واکنش نشادر با اکسید روی
از دیگر واکنشهای آمونیوم کلراید (نشادر) میتوان به واکنش آن با اکسید روی پرداخت. نشادر از موادی است که میتواند به عنوان الکترولیت در باتری روی کربن مورد استفاده قرار گیرد. در فرایند تولید لیچینگ نیز محلول نشادر به کار میرود، اما باید دقت کرد که محلول باید غلیظ باشد.
همچنین، در صورت ترکیب با اکسیدهای فلزی کمپلکس ایجاد میشود. در مثال پیش رو واکنشی دیگر از نشادر قابل ملاحظه میباشد. در این واکنش میتوانید روی اکسید را مشاهده کنید که در هنگام واکنش با این ماده تشکیل روی آمونیوم کلرید میدهد
ZnO+NH4Cl→Zn(NH3)2Cl2+H2O
واکنشی که در بالا ذکر کردیم میتواند برای اکسیدهای فلزیای مانند مس و کادمیوم نیز اتفاق بیفتد.
بیشتر بخوانید: روش ساخت کربن اکتیو

واکنش کلرید آمونیوم با مس
واکنشی که در بالا ذکر کردیم میتواند در واکنش با مس نیز به کار رود. همچنین محلول آن نیز برای کاربردهای مختلفی مورد استفاده قرار میگیرد. چنانچه واکنشهای آمونیوم کلراید (نشادر) با مس باشد، میتواند اکسیدهای فلزی کمپلکس نیز به ارمغان آورد.
واکنش کلرید آمونیوم با کادمیوم
آمونیوم کلراید در حاصلخیزی خاک و بهبود فرایند کشاورزی مفید میباشد و میتواند باعث رشد بهتر گیاهان شود. این ماده هم مقرون به صرفه است و جذب بیشتر کادمیم را به همراه دارد.
آمونیوم کلرید میتواند از ترکیب کلرید آمونیوم با کادمیوم حاصل شود. چنانچه کلرید آمونیوم با اکسیدهای فلزی وارد واکنش شود، اکسیدهای فلزی کمپلکس ایجاد خواهند شد.
در ادامه به معرفی برخی از واکنشهای متداول نشادر میپردازیم:
در صورتی که آمونیوم کلرید در معرض حرارت قرار گیرد، تجزیه میشود و به آمونیاک و هیدروکلریک اسید تجزیه میشود. واکنش آن در زیر قابل مشاهده است:
NH4Cl → NH3 + HCl
چنانچه نشادر با یک باز قوی واکنش دهد گاز آمونیاک تولید و آزاد خواهد شد. در ادامه واکنش این ماده را با سدیم هیدروکسید خواهیم دید:
NH4Cl + NaOH → NH3 + NaCl + H2O
لینک های مرتبط:


0 دیدگاه